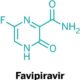
DIBALIK KEGAGALAN UJI REMDESIVIR: BIJAK MENGENAL OBAT
Remdesivir, yang digadang-gadang sebagai obat yang potensial untuk COVID19 ternyata tidak memiliki dampak yang signifikan dibandingkan dengan placebo. Berdasarkan jurnal yang diterbirkan oleh The Lancet (1), menyebutkan bahwa hasil uji pertama pada 237 pasien tidak menunjukkan dampak yang signifikan antara pasien yang diberi remdesivir dengan pasien yang menerima obat tanpa bahan aktif (plasebo). Dalam uji klinis ini, 158 pasien yang diterapi dengan remdesivir menghasilkan 14% kematian, dibandingkan dengan placebo yang menghasilkan hampir 13% kematian. Selain itu 11,6% pasien menghentikan terapi karena mengalami efek samping obat, dibandingkan dengan 5% pada kelompok kontrol. Bahkan dilaporkan 102 pasien mengalami efek samping obat dibandingkan dengan 50 pasien yang diterapi dengan plasebo. Hal ini tentu mengejutkan banyak pihak karena Remdesivir (GS-5734) yang merupakan prodrug dari monofosforamidat dikenal sebagai antivirus spektrum luas untuk terapi infeksi virus golongan filovirus, paramyxovirus, pneumovirus, and coronavirus.
Hasil uji in vitro menyebutkan bahwa remdesivir mampu menghambat semua coronavirus pada manusia dan hewan termasuk virus SARS-CoV-2 penyebab COVID19. Remdesivir menjadi penghambat yang potensial untuk replikasi virus SARS-CoV-2 pada sel epitel hidung dan bronkus. Bahkan pada uji in vivo pada monyet yang diinfeksi oleh SARS-CoV-2, pemberian awal remdesivir menunjukkan efek klinik dan antiviral yang signifikan, ditandai dengan penurunan cairan pada paru-paru dan jumlah titer virus dari hasil pemeriksaan cairan pada bronkus dan alveolus (1). Meskipun demikian, ternyata hasil uji pada manusia memberikan hasil yang berbeda. Hal ini lah yang perlu disadari oleh banyak pihak bahwa obat yang menghasilkan efek yang signifikan pada uji praklinik (uji pada hewan atau sel) belum tentu menghasilkan efek yang sama jika diberikan secara langsung ada manusia. Sekaligus memberi gambaran bahwa obat yang beredar secara resmi dipasaran sebenarnya melalui tahapan yang panjang, mahal dan melelahkan untuk dapat dirilis secara resmi sebagai obat dengan klaim “mengobati” atau “menyembuhkan” penyakit tertentu. Hal ini karena obat yang akan dirilis di pasaran harus melewati beberapa tahap uji berikut:
-
Uji praklinik.
Pengujian ini dilakukan untuk “kandidat” obat untuk memperoleh informasi tentang efek farmakologi, profil farmakokinetik dan toksisitas dari “kandidat” obat. Uji praklinik dibagi menjadi 2 jenis yakni uji invitro dan in vivo. Uji in vitro adalah pengujian “kandidat” obat diluar tubuh makhluk hidup. Pengujian ini dilakukan pada kultur bakteri, sel terisolasi atau organ terisolasi. Jika hasilnya positif, kan dilanjutkan dengan uji in vivo yakni pengujian pada makhluk hidup (hewan) (2). Hewan yang digunakan adalah hewan yang diketahui genetiknya atau dikenal dengan galur tertentu dari mencit, tikus, kelinci, marmut, babi, anjing atau primata. Melalui pengujian ini akan bisa diprediksi efek penggunaan obat pada manusia terutama terkait efek toksik yang dihasilkan. Penelitian toksisitas merupakan cara potensial untuk mengevaluasi efek samping obat akibat konsumsi jangka pendek dan jangka panjang, kerusakan atau mutase genetik (genotoksisitas atau mutagenisitas), pertumbuhan sel kanker (karsinogenisitas) dan kecacatan pada janin (teratogenisitas). Selain toksisitas, pengujian pada hewan juga dilakukan untuk mempelajari nasib obat dalam tubuh (farmakokinetik) “kandidat” obat yang meliputi absorpsi, distribusi, metabolisme dan eliminasi obat. Semua hasil pengujian pada hewan tersebut menjadi bahan evaluasi untuk menentukan apakah “kandidat” obat tersebut dapat dilanjutkan dengan uji pada manusia atau tidak (3). Senyawa atau molekul “kandidat” obat yang lolos uji praklinik, maka disebut IND (Investigational New Drug) atau obat baru dalam penelitian selanjutnya akan diuji pada manusia (uji klinik).
-
Uji Klinik.
Uji klinik merupakan penelitian yang dilakukan pada obat baru yang bertujuan untuk mengevaluasi dampaknya pada Kesehatan manusia. Uji klinik dirancang, dilaksanakan dan dievaluasi secara ketat untuk memastikan keamanan subjek uji. Pengujian ini baru dapat dilalsanakan setelah melewati uji dulu kelayakan oleh komite etik sesuai Deklarasi Helsinki. Uji klinik terdiri dari 4 fase yaitu :
- Fase 0, Fase ini merupakan fase pendahuluan yang dilakukan pada sukarelawan sehat. Fase ini merupakan pendahuluan sebelum fase sebenarnya. Fase ini dilakukan dengan pemberian obat pada dosis yang sangat kecil yang tidak memiliki efek terapi untuk mengetahui apakah sifat yang diamati pada hewan percobaan juga terlihat pada manusia (4).
- Fase I, Fase ini merupakan fase pengujian yang sesungguhnya. Fase ini berfokus pada aspek keamanan dari obat baru. Fase ini dilakukan pada sukarelawan sehat dalam jumlah kecil berkisar antara 20 – 100 orang (5) untuk mengamati efek samping yang paling sering muncul dan yang paling berbahaya dari obat baru serta untuk mengamati profil farmakokinetik obat pada manusia (4).
- Fase II, Fase ini difokuskan untuk mengamati efektivitas obat baru. Obat baru diuji pada pasien dengan kondisi/penyakit tertentu, kemudian diamati efek yang timbul pada penyakit yang diobati. Hal yang diharapkan dari obat adalah mempunyai efek yang potensial dengan efek samping rendah atau tidak toksik. Pengujian pada fase ini kelompok pasien yang diterapi dengan obat baru biasanya akan dibandingkan dengan kelompok pasien yang diterapi dengan obat lain atau obat tanpa bahan aktif (plasebo) (4). Fase ini juga mengevaluasi keamanan dan efek samping jangka pendek serta mulai dilakukan pengembangan dan uji stabilitas bentuk sediaan obat (3).
- Fase III,Fase ini merupakan fase yang berfokus untuk mengamati keamanan dan efektivitas obat baru pada populasi yang berbeda, dosis yang berbeda dan menggunakan obat baru yang dikombinasikan dengan obat lain dengan melibatkan kelompok besar pasien. Fase ini menilai variabilitas efektivitas obat pada popolasi yang beragam. Setelah melewati uji klinis fase III inilah umumnya banyak obat baru yang ditolak atau tidak layak digunakan. Hingga akhirnya mungkin hanya 1 : 10.000 obat baru yang lolos untuk dipasarkan karena memiliki kelebihan dalam hal efikasi dan keamanan maupun efek samping dan resiko yang lebih kecil dibandingkan obat yang ada. Keputusan untuk menyetujui obat baru untuk dipasarkan dilakukan oleh badan khusus, seperti Badan Pengawas Obat dan Makanan di Indonesia, FDA (Food and Drug Administration) di Amerika Serikat, MHRA (Medicine and Healthcare Product Regulatory Agency) di Inggris, EMEA (European Agency for the Evaluation of Medicinal Product) di negara Eropa lain dan TGA (Therapeutics Good Administration) di Australia. Selanjutnya obat baru yang lolos uji klinis fase III diizinkan untuk diproduksi dan dipasarkan dengan nama dagang tertentu oleh industri farmasi sebagai legal drug serta dapat diresepkan oleh dokter (3).
- Fase IV, Fase ini sebenarnya bukan pengujian yang sesungguhnya, melainkan studi pasca pemasaran (post marketing surveillance) setelah obat disetujui untuk dipasarkan. Fase ini mengamati penggunaan obat pada pasien dengan berbagai kondisi, berbagai usia dan ras yang bertujuan untuk mengevaluasi lebih lanjut tingkat keamanan, efikasi dan kodisi penggunaan yang optimal (6). Setelah hasil studi fase IV dievaluasi masih memungkinkan obat ditarik dari perdagangan jika membahayakan sebagai contoh dekstroksipropoksifen suatu obat penghilang nyeri yang bahkan sudah digunakan selama 40 ditarik dari perdagangan karena efek kematian akibat overdosis(7), lepirudin suatu obat antikoagulan ditarik dari pasar eropa karena efek samping anafilaksis yang parah (8) dan yang terkini penarikan ranitidin dari pasaran karena tercemar NMDA yang dapat menimbulkan kanker.
Karena syarat yang sangat ketat itulah tidak mudah utuk suatu molekul obat untuk bisa beredar sebagai obat. Hal ini berlaku di negara-negara Eropa, Amerika Serikat dan negara-negara maju lainnya. Jangka penemuan obat baru sejak awal ditemukan suatu molekul kimia baru sampai menjadi obat baru yang diijinkan beredar memerlukan waktu kurang 5 – 10 tahun dan total biaya penelitian saat ini mencapai USD 2.870 juta (Rp. 45.920 Trilyun) (9).
Demikianlah petualangan panjang suatu molekul kimia sebelum obat diedarkan ke masyarakat. Dengan biaya yang terus meningkat serta waktu penelitian yang lama, tidaklah mengherankan jika harga obat, terutama obat-obat yang masih dilindungi masa paten, harganya sangatlah mahal. Hal ini tentu demi kebaikan umat manusia itu sendiri, untuk memastikan obat yang dikonsumsi aman, berkhasiat serta jelas identitasnya.
Catatan:
Meski uji klinis fase 2 hasilnya tidak memuaskan, tetapi Gilead Sciences.Inc tetap melanjutkan untuk uji klinis fase III untuk remdesivir dengan model SIMPLE di negara-negara yang memiliki prevalensi COVID19 yang tinggi. Studi mengevaluasi efikasi dan keamanan pemberian remdesivir selama 5 dan 10 hari untuk pasien COVID19 yang parah dengan regimen 200 mg pada hari pertama dan 100 mg pada hari selanjutnya dengan jumlah pasien mencapai 5600 orang yang tersebar pada 180 tempat pengujian diseluruh dunia, meliputi Amerika Serikat, China, Prancis, Jerman, Hongkong, Italia, Jepang, Korea Selatan, Belanda, Singapura, Spanyol, Swedia, Swiss, Taiwan dan Inggris (10).
Sumber:
- Wang Y, Zhang D, Du G, Du R, Zhao J, Jin Y, et al. Remdesivir in adults with severe COVID-19: a randomised, double-blind, placebo-controlled, multicentre trial. The Lancet. 2020 Apr;S0140673620310229.
- Commissioner O of the. Step 2: Preclinical Research. FDA [Internet]. 2019 Apr 18 [cited 2020 May 2]; Available from: https://www.fda.gov/patients/drug-development-process/step-2-preclinical-research
- Priyambodo B. Jalan Panjang Penemuan Obat Baru [Internet]. Bambang Priyambodo’s Weblog. 2014 [cited 2020 May 2]. Available from: https://priyambodo1971.wordpress.com/2014/03/27/jalan-panjang-penemuan-obat-baru/
- Clinical trials Questions and Answers [Internet]. [cited 2020 May 2]. Available from: https://www.who.int/news-room/q-a-detail/clinical-trials-questions-and-answers
- Commissioner O of the. Step 3: Clinical Research. FDA [Internet]. 2019 Apr 18 [cited 2020 May 2]; Available from: https://www.fda.gov/patients/drug-development-process/step-3-clinical-research
- Learn About Clinical Studies – ClinicalTrials.gov [Internet]. [cited 2020 May 2]. Available from: https://clinicaltrials.gov/ct2/about-studies/learn#ClinicalTrials
- WHO. Alert_123_Dextropropoxyphene.pdf [Internet]. WHO Newsletter. 2009 [cited 2020 May 2]. Available from: https://www.who.int/medicines/publications/drugalerts/Alert_123_Dextropropoxyphene.pdf?ua=1
- Petersen PE. World Health Organization. Organisation Mondiale de la Sante. Community Dent Oral Epidemiol. 2003 Dec;31(6):471–471.
- DiMasi JA, Grabowski HG, Hansen RW. Innovation in the pharmaceutical industry: New estimates of R&D costs. J Health Econ. 2016 May;47:20–33.
- Gilead Announces Results From Phase 3 Trial of Investigational Antiviral Remdesivir in Patients With Severe COVID-19 [Internet]. [cited 2020 May 2]. Available from: https://www.gilead.com/news-and-press/press-room/press-releases/2020/4/gilead-announces-results-from-phase-3-trial-of-investigational-antiviral-remdesivir-in-patients-with-severe-covid-19.
Penulis: apt. Ardi Nugroho, M.Sc. (Desen Jurusan Farmasi, Universias Islam Indonesia)